Exp Hematol Oncol.|复旦大学附属中山医院詹成团队揭示:肌氨酸双重机制激活铁死亡,增强肺腺癌顺铂敏感

英文标题:Sarcosine sensitizes lung adenocarcinoma to chemotherapy by dual activation of ferroptosis via PDK4/PDHA1 signaling and NMDAR-mediated iron export
中文标题:肌氨酸通过PDK4/PDHA1信号通路双重激活铁死亡及NMDAR介导的铁输出使肺腺癌对化疗敏感
发表期刊:Experimental hematology & oncology
影响因子:9.4
客户单位:复旦大学附属中山医院
百趣提供服务:非靶标代谢流
研究背景
肺癌是全球癌症相关死亡的主要原因,其中肺腺癌(Lung Adenocarcinoma, LUAD)是非小细胞肺癌中最常见的亚型,尽管治疗手段不断进步,其五年生存率仍不足26%,化疗耐药是导致预后不良的关键因素之一。铁死亡作为一种铁依赖的脂质过氧化程序性细胞死亡方式,因其能克服传统治疗耐药性而成为研究热点。越来越多证据表明,调控铁死亡可增强肿瘤对化疗的敏感性,但如何精准诱导铁死亡并阐明其代谢调控机制仍不明确。肌氨酸作为内源性代谢物,在前列腺癌等肿瘤中与侵袭转移相关,但其在LUAD中的作用未知。本研究通过代谢组学筛选发现肌氨酸显著增强LUAD细胞对铁死亡诱导剂(Ferroptosis Inducers, FINs)的敏感性。结合临床数据与机制研究,证实肌氨酸通过双重机制调控铁死亡。此外,肌氨酸与顺铂联用可协同增强化疗敏感性,且临床样本中高肌氨酸水平与患者预后改善相关。本研究填补了肌氨酸在铁死亡和LUAD中作用的空白,为克服化疗耐药提供了新靶点,其安全性和代谢调控特性使其有望成为铂类化疗的潜在佐剂,具有重要临床转化价值。
研究结果
1、代谢物文库筛选揭示肌氨酸增强LUAD细胞铁死亡敏感性
为筛选调控铁死亡的关键代谢物,并验证肌氨酸是否通过特定机制增强LUAD细胞对铁死亡的敏感性,研究首先对铁死亡诱导剂RSL3处理的LUAD细胞系(A549和PC9)进行非靶代谢组学分析,发现肌氨酸显著下调等独特代谢特征(图1A-B)。随后在RSL3诱导的铁死亡模型中,利用包含889种人类内源性代谢物的文库进行筛选,确定肌氨酸为RSL3介导铁死亡的强效增强剂(图1C-D)。
细胞毒性实验显示,肌氨酸与铁死亡诱导剂(如RSL3、IKE)联用可显著降低细胞活力,且该协同效应可被铁死亡抑制剂[脂质过氧化清除剂(Ferrostatin-1, Fer-1)、铁螯合剂(Deferoxamine, DFO)]完全消除,但不受凋亡抑制剂(Z-VAD-FMK)或坏死性凋亡抑制剂(Necrosulfonamide)影响,确认肌氨酸促铁死亡作用的特异性(图1E–H)。进一步检测显示,外源性肌氨酸显著增强RSL3诱导的脂质活性氧(Lipid-ROS)生成(图1I)、胞内亚铁离子积累(图1J)和丙二醛(MDA)水平升高(图1K)。透射电镜观察到肌氨酸处理后细胞线粒体嵴消失、体积缩小等铁死亡特征性超微结构改变(图1L)。
综上,肌氨酸通过增强铁依赖的脂质过氧化和线粒体功能紊乱,显著提升LUAD细胞对铁死亡的敏感性。

图1. 代谢物文库筛选揭示肌氨酸与铁死亡相关
2、肌氨酸通过代谢重编程增强铁死亡敏感性
为探究肌氨酸调控铁死亡的机制,首先采用15N-肌氨酸同位素追踪代谢流分析,发现肌氨酸在LUAD细胞中极少转化为甘氨酸等下游代谢物(图2A)。使用透析血清(去除小分子物质)培养细胞后,细胞内肌氨酸几乎不可检测,证实其主要来源于培养基血清,而非细胞从头合成。这一结果排除了肌氨酸通过甘氨酸代谢(如谷胱甘肽合成)发挥作用的可能。
进一步通过非靶代谢组学分析发现,肌氨酸处理后,丙酮酸水平显著降低,柠檬酸水平显著升高,差异代谢物显著富集于三羧酸循环(TCA cycle)通路(图2B-C)。Seahorse能量代谢检测显示,肌氨酸诱导细胞外酸化率(Extracellular Acidification Rate, ECAR)降低、耗氧率(Oxygen Consumption Rate, OCR)升高,证实代谢模式从糖酵解向氧化磷酸化转变(图2D)。活性氧(Reactive Oxygen Species, ROS)检测显示,肌氨酸处理组总 ROS 和线粒体 ROS 荧光强度显著增加,提示线粒体电子传递链电子泄漏增加,导致超氧阴离子生成增多(图2E-F)。此外,通过丙酮酸脱氢酶(PDH)活性检测发现,肌氨酸可显著激活PDH,推动代谢通量进入TCA循环。
综上,肌氨酸通过外源补充直接激活PDH,重塑代谢通路为氧化磷酸化模式,增强线粒体ROS爆发并打破氧化还原平衡,从而特异性提升LUAD细胞对铁死亡的敏感性。该效应不依赖于肌氨酸的代谢转化(如代谢为甘氨酸),而是通过调控代谢流实现。
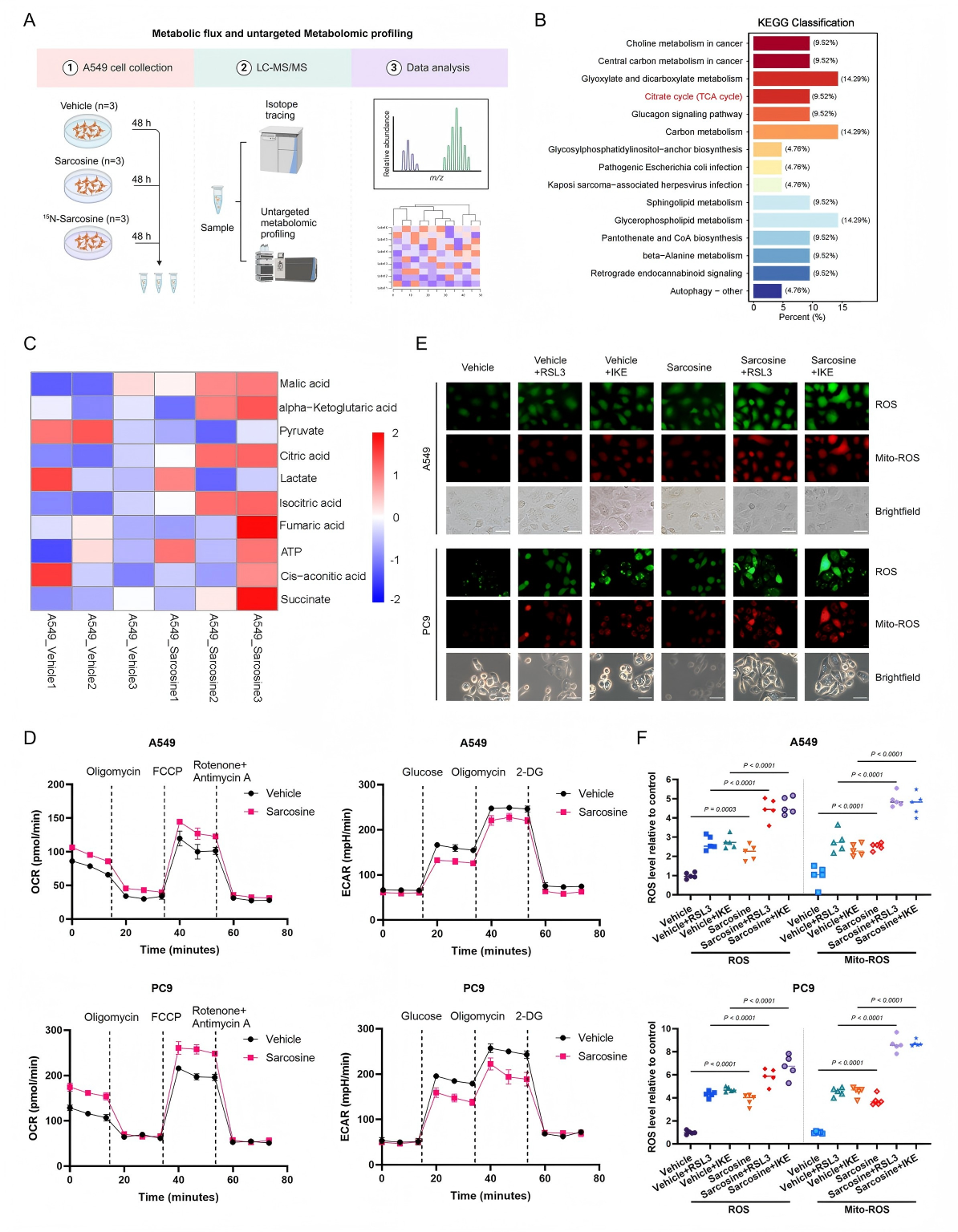
图2. 肌氨酸重塑细胞代谢以增强铁死亡
3、肌氨酸通过抑制PDK4激活三羧酸循环
为探究肌氨酸诱导代谢转向氧化磷酸化并增强铁死亡敏感性的机制,研究发现肌氨酸可显著激活丙酮酸脱氢酶(Pyruvate Dehydrogenase, PDH)活性(图3A),并降低PDHA1(PDH复合物E1α亚基)S293 位点磷酸化水平(图3B)。分子对接实验显示,肌氨酸与PDK4的BCDHK_Adom3结构域特异性结合(图3C)。
通过CRISPR/Cas9技术构建PDK4敲除(PDK4-KO)细胞及BCDHK_Adom3结构域突变体(ΔAdom3,删除 Asp118、Asp182、Ser183),发现PDK4缺失或BCDHK_Adom3结构域突变完全消除了肌氨酸对PDH活性的激活作用(图3D)和PDHA1磷酸化的抑制效应(图3E)。进一步检测显示,PDK4-KO细胞的线粒体ROS(Mito-ROS)水平在肌氨酸处理后显著低于野生型细胞(图3F-G),且对FINs(RSL3/IKE)的敏感性显著增强(图3H-I)。
综上,肌氨酸通过直接结合PDK4的BCDHK_Adom3结构域,抑制其对PDHA1的磷酸化作用,从而激活PDH并推动代谢通量进入三羧酸循环。PDK4抑制是肌氨酸通过代谢重编程增强铁死亡的核心分子机制。

图3. 肌氨酸抑制PDK4,驱动TCA循环激活
4、肌氨酸激活NMDAR/MXD3信号通路以调控SLC40A1
为探究肌氨酸是否通过N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor, NMDAR)信号通路调控铁死亡及其分子机制,研究发现肌氨酸处理显著下调亚铁离子输出跨膜蛋白SLC40A1的表达(图4A)。DEPMAP数据显示,LUAD细胞中SLC40A1表达与肌氨酸丰度呈负相关(图4B)。功能实验表明,肌氨酸可升高细胞内亚铁离子水平(可被DFO逆转),并负调控SLC40A1蛋白表达,而NMDAR拮抗剂MK-801则显著逆转这一效应(图4C-E)。
转录组学分析进一步筛选出HLX、HSF4、MXD3和SCX为差异最显著的转录因子(图4F)。聚焦MXD3发现,其在LUAD中与SLC40A1表达呈负相关(图4G)。构建MXD3敲低/过表达细胞系证实,MXD3缺失可显著上调SLC40A1(图4H-I),而免疫组化显示,LUAD组织中MXD3与SLC40A1表达负相关,与脂质过氧化标志物4-HNE正相关(图4J-K)。ChIP-qPCR证实MXD3直接结合于SLC40A1启动子区域(图4L),荧光素酶报告基因实验进一步显示,MXD3可抑制SLC40A1野生型启动子活性(图4M)。
综上,肌氨酸通过激活NMDAR,诱导MXD3介导的SLC40A1转录抑制,减少铁输出并导致细胞内铁蓄积,从而增强LUAD细胞对铁死亡的敏感性。
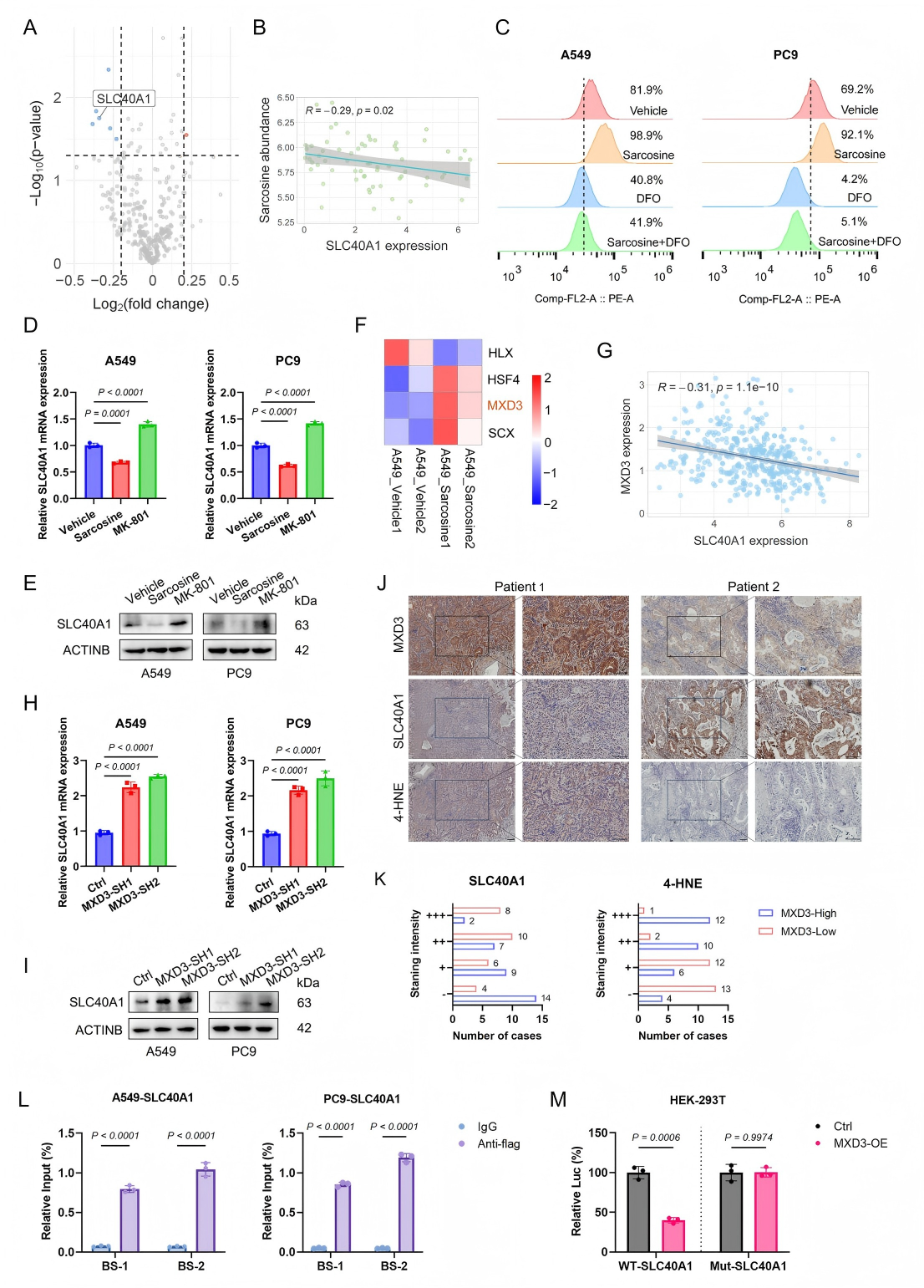
图4. 肌氨酸激活NMDAR/MXD3信号通路以调控SLC40A1
5、PDK4激活和NMDAR阻断逆转肌氨酸介导的铁死亡
为研究PDK4和NMDAR对肌氨酸诱导铁死亡的调节作用,通过构建过表达PDK4的LUAD细胞系(图5A-B)并结合NMDAR药理学抑制实验,发现PDK4异位表达与NMDAR拮抗剂MK-801联用(10 µM),可显著减弱肌氨酸的促铁死亡效应。具体表现为:肌氨酸联合RSL3/IKE诱导的脂质活性氧水平显著降低(图5D),且细胞对铁死亡诱导剂的敏感性降低(图5C)。
综上,PDK4激活与NMDAR阻断可协同逆转肌氨酸介导的铁死亡,揭示两者在肌氨酸调控铁死亡通路中的关键作用(图5C-D)。

图5. PDK4激活和NMDAR阻断逆转肌氨酸介导的铁死亡
6、肌氨酸通过铁死亡增强CDDP敏感性
为探究肌氨酸是否通过铁死亡途径增强LUAD对顺铂(Cisplatin, CDDP)化疗的敏感性,并验证其临床相关性,研究在LUAD细胞中添加外源性肌氨酸并联合CDDP处理,发现肌氨酸可显著提高细胞对CDDP的敏感性,且该效应能被铁死亡抑制剂(Fer-1、DFO)削弱,证实其依赖铁死亡途径(图6A-C)。单细胞测序分析显示,NMDAR亚基编码基因(GRIN1、GRIN2D)在肿瘤细胞中优先表达,提示肌氨酸作用的肿瘤特异性(图6D-G)。
临床样本分析显示,在120例LUAD患者中,高肌氨酸水平组总生存期(OS)显著优于低肌氨酸水平组(图6H);在41例接受CDDP化疗的亚组中,高肌氨酸水平患者OS呈改善趋势(图6I),且血清肌氨酸水平与OS呈正相关。综上所述,这些数据强调了肌氨酸在增强顺铂疗效和改善LUAD患者预后中的治疗潜力。

图6. 肌氨酸通过铁死亡增强CDDP的敏感性
7、肌氨酸在患者来源PDOs和异种移植模型中增强治疗效果
为在临床前模型中验证肌氨酸增强铁死亡及化疗敏感性的机制,研究通过慢病毒转染构建PDK4过表达的LUAD类器官(Patient-Derived Organoids, PDOs)模型。形态学观察显示,肌氨酸处理导致PDOs萎缩,ATP酶活性检测证实其代谢活性降低(图7A-B),且对铁死亡诱导剂(FINs)和顺铂(CDDP)的敏感性显著提升(图7C)。NMDAR拮抗剂MK-801处理可显著消除肌氨酸的增敏作用(图7D-E)。
在体内异种移植模型中,对照荷瘤小鼠(Ctrl)接受IKE(40 mg/kg)、CDDP(3 mg/kg)联合肌氨酸(2 mM饮水)治疗时,肿瘤生长显著抑制(图7G-I),而PDK4过表达肿瘤或MK-801处理组中肌氨酸的增强效应消失。多重免疫组织化学(mIHC)分析显示,肌氨酸治疗组肿瘤组织中脂质过氧化标志物4-HNE显著升高,而PDK4过表达或MK-801处理可逆转这一效应(图7J)。
综上,肌氨酸通过依赖PDK4抑制和NMDAR激活的双重机制增强铁死亡和化疗敏感性,在克服LUAD治疗耐药性方面展现出显著治疗潜力。
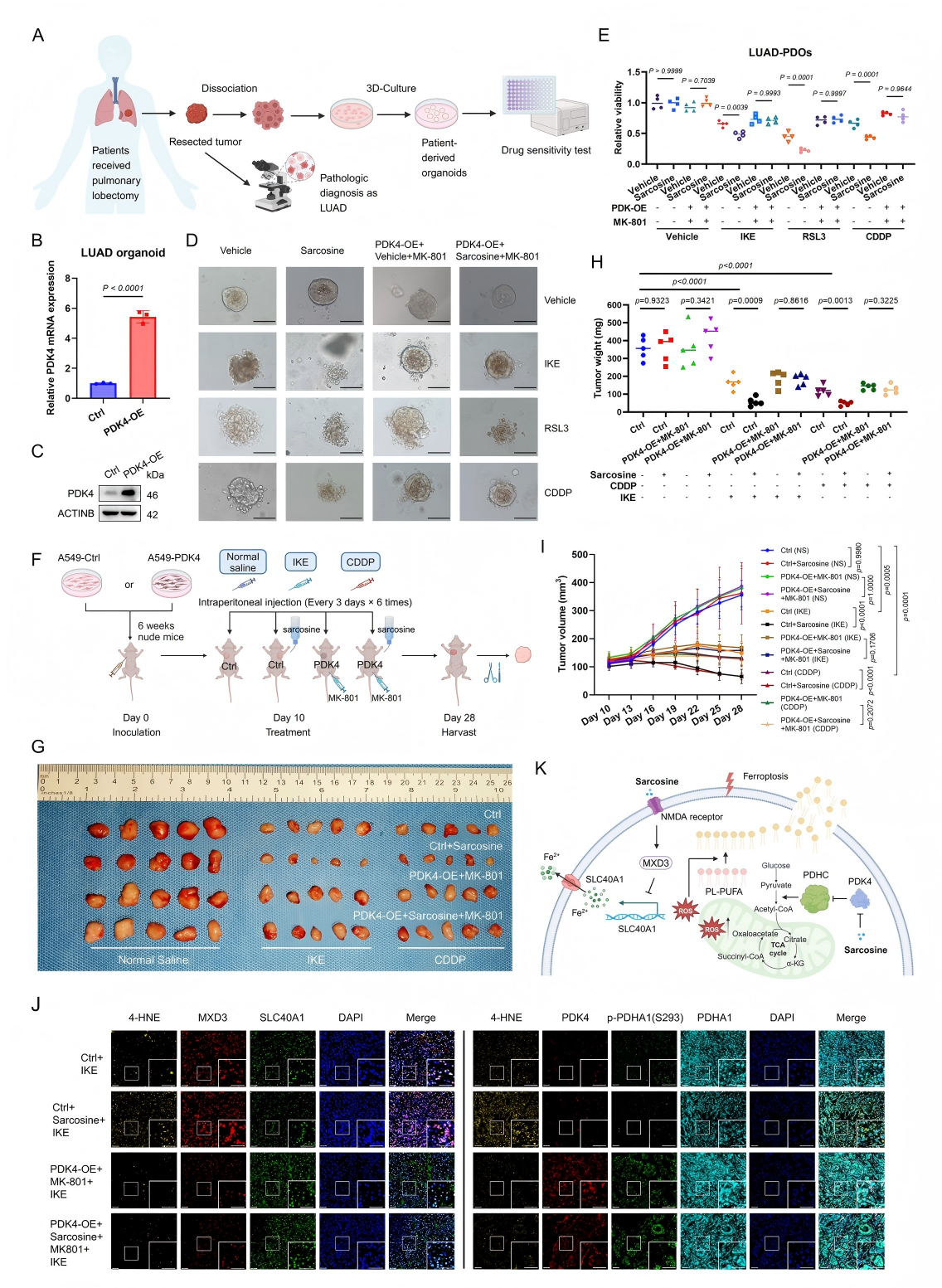
图7. 肌氨酸在患者来源类器官(PDOs)和异种移植模型中增强治疗效果
研究结论
本研究发现肌氨酸可通过双重机制增强肺腺癌(LUAD)细胞对铁死亡和化疗的敏感性:一方面,肌氨酸结合PDK4抑制其活性,激活丙酮酸脱氢酶(PDH)推动代谢转向氧化磷酸化,增加线粒体活性氧(ROS)生成;另一方面,作为NMDAR共激活剂,肌氨酸通过MXD3抑制铁输出蛋白SLC40A1转录,导致细胞内铁蓄积,协同诱导铁死亡。在细胞模型、患者来源类器官(PDOs)及异种移植模型中,肌氨酸均显著增强顺铂化疗效果,且临床样本显示其水平与患者总生存期正相关,提示肌氨酸有望成为LUAD治疗的潜在辅助药物。
END
张攀容 撰文
Tang 校稿
